News & Presse
Programmieren mit dem Lichtschalter
Freiburger Forscher zeigen, wie sich einzelne Komponenten selbstorganisierender molekularer Strukturen steuern lassen
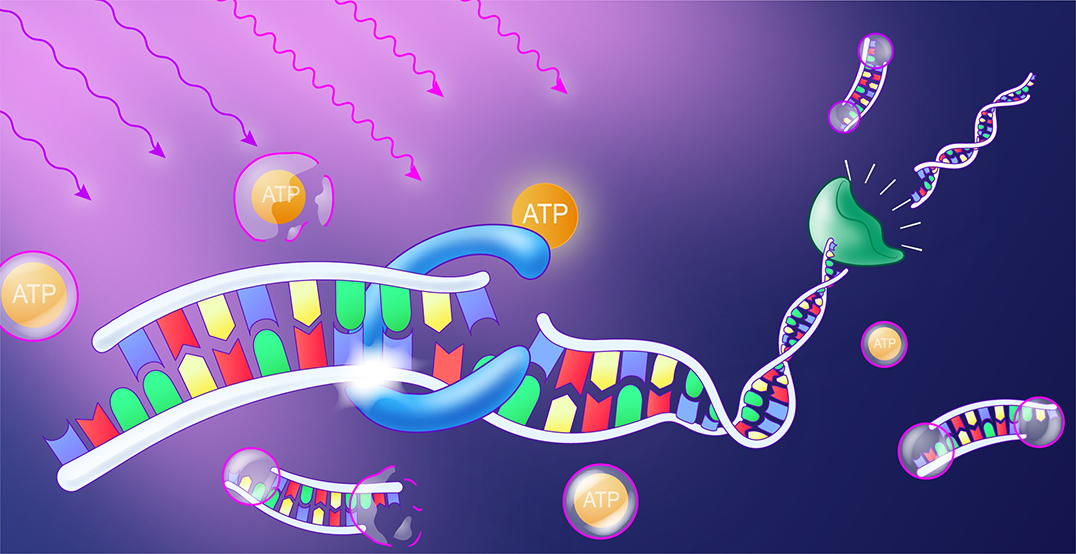
Bei Lichteinwirkung wird das Molekül ATP freigesetzt. Es liefert die Energie für ein Enzym (blau), das DNA-Bausteine zu einem Strang verbindet. Ein weiteres Enzym (grün) trennt den Strang an diesen Bindestellen wieder, sodass sich der Strang dynamisch verlängert und verkürzt. (Illustration: Michal Rössler)
In der Entwicklung autonomer Systeme und Materialien gewinnen selbstorganisierende molekulare Strukturen, die durch chemische Reaktionsnetzwerke gesteuert sind, zunehmend an Bedeutung. Jedoch fehlt es bisher an einfachen externen Mechanismen, die sicherstellen, dass die Komponenten dieser Reaktionsnetzwerke kontrolliert aktiviert werden. Ein Forschungsteam um Prof. Dr. Andreas Walther und Prof. Dr. Henning Jessen vom Exzellenzcluster Living, Adaptive and Energy-autonomous Materials Systems (livMatS) und Jie Deng vom Institut für Makromolekulare Chemie der Universität Freiburg zeigt erstmals, wie sich einzelne Bausteine von selbstorganisierenden Strukturen auf DNA-Basis mit lichtreaktiven Photoschaltern aktivieren und steuern lassen. Ihre Ergebnisse haben die Forschenden in der Fachzeitschrift Angewandte Chemie veröffentlicht.
Bei der Entwicklung selbstorganisierender Strukturen dienen den Forschenden biologische Vorbilder wie die Mikrotubuli. Diese Proteinkomplexe bilden eine dynamische Gerüststruktur in Zellen von Pflanzen, Tieren und Menschen. Aufgrund ihrer selbstorganisierenden Struktur bauen sich die Mikrotubuli ständig zeitgleich auf und ab. Dadurch kann sich das Zellgerüst leicht an veränderte Situationen anpassen und durch Umlagerung der Bausteine schnell auf Reize reagieren. Ähnlich anpassungsfähig sollen künftig auch die Strukturen autonom agierender Materialien sein, wie sie die Wissenschaftlerinnen und Wissenschaftler im Exzellenzcluster livMatS entwickeln. Dies kann mit Systemen erreicht werden, in denen eine energetische De- und Aktivierung zum strukturellen Ab- sowie Einbau von Bausteinen erfolgt.
In ihrer Arbeit führen die Freiburger Forschenden den DNA-Bausteinen in einem solchen System den Energielieferanten Adenosintriphosphat (ATP) zu. An eine Seite des ATP haben die Wissenschaftler molekulare Photoschalter gesetzt. Diese reagieren auf Licht, indem sie bei gezielter Bestrahlung abfallen und das ATP als wirksames Treibstoffmolekül für das System freigeben. Die Lichtwellenlänge, die Dauer der Bestrahlung und die Lichtstärke beeinflussen dabei die Steuerung der Photoschalter. Die Aktivierung des ATP setzt wiederum einen Prozess in Gang: Eine Bindung, die aus den DNA-Monomeren längere Stränge bildet, wird durch ein Enzym geschlossen. Ein anderes Enzym, das DNA an bestimmten Positionen erkennen und schneiden kann, spaltet die Verbindungsstellen wieder. Auf diese Weise werden die DNA-Bausteine an definierten Stellen getrennt und neu zusammengefügt. Es findet ein gleichzeitiger Auf- und Abbau der Bausteine statt. Im Laufe dieses Prozesses verbinden sich die einzelnen DNA-Bausteine zu einem Polymer.
„Unser langfristiges Ziel ist, unter Ausnutzung des biologischen Treibstoffs ATP synthetische Materialien zu entwickeln, die die Grenze zwischen lebender und toter Materie zumindest verwischen“, erklärt Andreas Walther. „Wenn wir in der Lage sind, ATP als Treibstoff zu nutzen und chemische Energie in Arbeit zu verwandeln, können wir die nächste Generation an Implantatmaterialien entwerfen, die sich aktiv verändern und mit dem Körper wirklich interagieren.“
Originalpublikation:
J. Deng, D. Bezold, H. Jessen, A. Walther: Multiple Light Control Mechanisms in ATP‐fueled Non‐Equilibrium DNA Systems), Angew. Chem. Int. Ed., doi: 10.1002/anie.202003102
https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202003102
