News & Presse
Künstliche Organellen als Gegenstück zur Biologie
Forschende stellen im Labor den Mechanismus nach, durch den sich membranlose Organellen in Zellen bilden
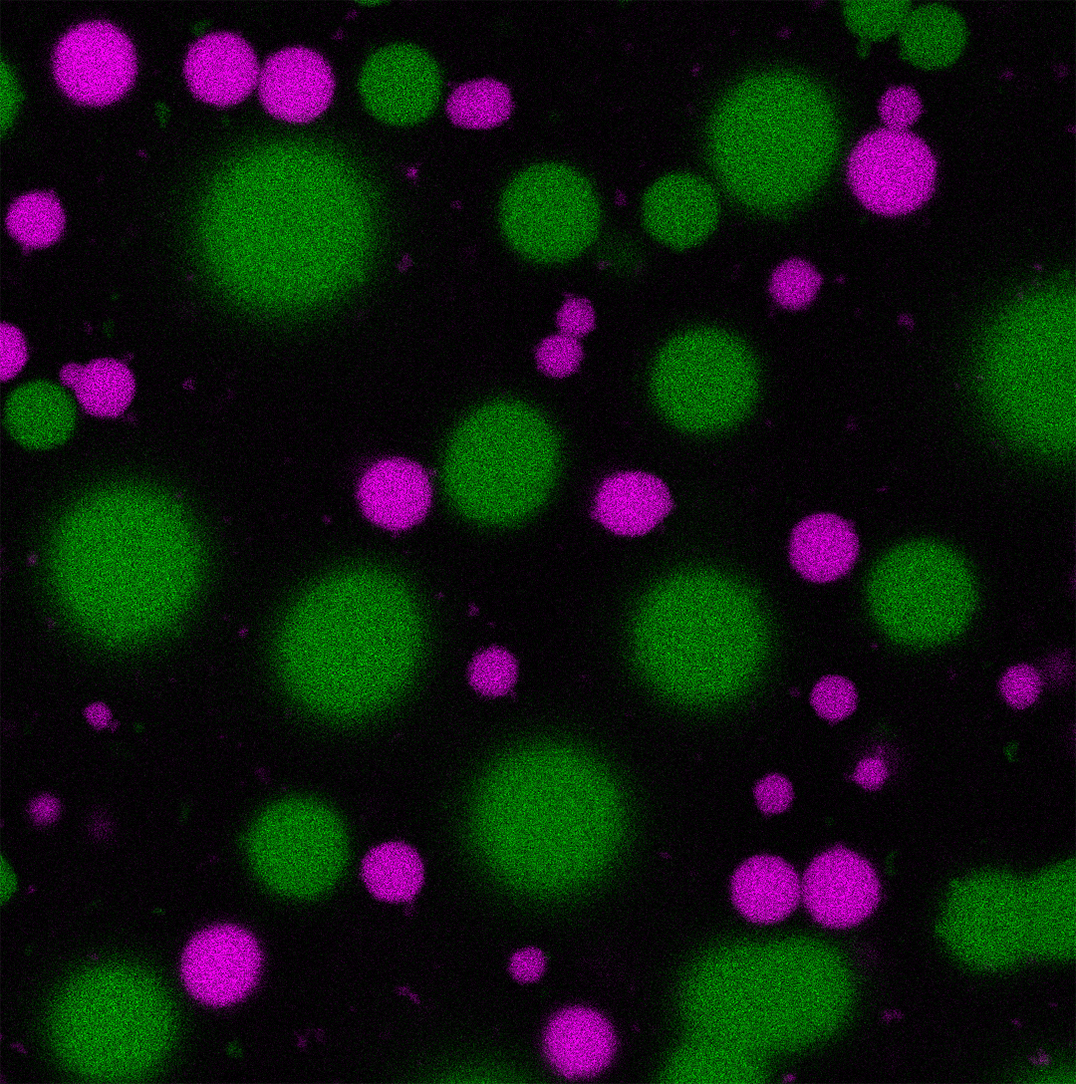
Diese Fluoreszenzmikroskopische Aufnahme zeigt Tröpfchen, die aus sich selbst-sortierenden DNA-Molekülen bestehen. Die Farbe in Grün und Magenta stammt von unterschiedlichen Fluoreszenzmarkierungen. Abbildung: A. Walther/ livMatS
In jeder lebenden Zelle laufen zahllose biochemische Prozesse gleichzeitig ab. Diese müssen fein aufeinander abgestimmt, und räumlich und zeitlich exakt organisiert sein. Ein grundlegender Prozess, der diese Organisation ermöglicht, ist die Flüssig-Flüssig-Phasentrennung (abgekürzt LLPS für Englisch: liquid-liquid phase separation). Sie führt zur Konzentration von Biomolekülen in membranlosen Kompartimenten, die wichtig für grundlegende Funktionen sind, wie etwa für die Regulierung der Genexpression. Membranlose Kompartimente können während des Lebenszyklus der Zelle dynamisch ihre Größe, Anzahl und Zusammensetzung verändern. Diesen dynamischen Anpassungen liegen multivalente Wechselwirkungen zwischen ihren molekularen Bestandteilen zugrunde.
Prof. Andreas Walther vom Exzellenzcluster "Lebende, adaptive und energieautonome Materialsysteme (livMatS)" und Jie Deng vom Institut für Makromolekulare Chemie der Albert-Ludwigs-Universität Freiburg ist es gelungen, das erste synthetische LLPS-System mit klar definierten Multivalenzprinzipien zu entwickeln. Diese Nachahmung natürlicher Prinzipien hat ein hohes Potenzial für die weitere Anwendung in der Grundlagenforschung, chemischer Synthese und der Entwicklung adaptiver Materialsysteme. Die Ergebnisse der Forscher wurden in der Fachzeitschrift Chem, einer Schwesterzeitschrift der Fachzeitschrift Cell, veröffentlicht.
Die Forscher bauen dabei auf einem zuvor beschriebenen System auf, das aus synthetischen DNA-Strängen sowie zwei Arten von Enzymen besteht, die die DNA entweder schneiden oder sie unter Verwendung von ATP als Energiequelle zu längeren Strängen verbinden können. Die DNA bildet dabei Tröpfchen, in denen die gleichzeitig ablaufenden Fragmentierungs- und Verlängerungsreaktionen zu einem Nicht-Gleichgewichtszustand führen, der eine festgelegte Lebensdauer aufweist, die sich aus der Verfügbarkeit von ATP-Treibstoffmolekülen ergibt.
Durch die gezielte Anpassung der DNA-Stränge konnten die Forscher erreichen, dass sich gleiche DNA-Stränge von alleine in denselben Tröpfchen zusammenfinden. Dadurch konnten sie mehrere dieser Systeme parallel betreiben. Durch die Anheftung von Enzymen an die selbst-sortierenden DNA-Stränge lassen sich räumlich begrenzte und voneinander getrennte Reaktionskompartimente schaffen.
Diese Kompartimente können in Zukunft als Reaktoren verwendet werden, die für bestimmte Zeiträume chemische Reaktionen katalysieren", sagt Jie Deng, der Erstautor der Studie. "Außerdem könnten multivalenzgetriebene LLPS Anwendungen in der Molekularbiologie finden, zum Beispiel für die Regulation der Rezeptor-Clusterbildung während der zellulären Signalübertragung.
Originalpublikation:
Jie Deng, Andreas Walther: Programmable ATP-Fueled DNA Coacervates by Transient Liquid-Liquid Phase Separation. In: Chem (2020), doi: doi.org/10.1016/j.chempr.2020.09.022
